大規模リン酸化プロテオミクス解析により 学習と記憶を制御するNMDA受容体シグナル伝達経路の解明に成功
—統合失調症などの精神・神経疾患や認知機能障害の新たな治療法開発への道を開く—
藤田医科大学(愛知県豊明市)精神・神経病態解明センターの貝淵弘三センター長、船橋靖広講師、永井拓教授、山下貴之教授らを含む研究グループは、大規模リン酸化プロテオミクス解析[注1]により、忌避学習[注2]を制御する細胞内シグナル伝達経路の一端を明らかにしました。本研究グループは、独自に開発した高感度で網羅的なリン酸化プロテオミクス解析法を用いて、神経細胞間の情報伝達において重要な役割を果たしている「NMDA受容体」(NMDAR)[注3]の活性化後に起こる細胞内のタンパク質リン酸化[注4]反応を大規模に解析し、100種類以上のタンパク質とそのリン酸化部位を同定することに成功しました。さらに、細胞や動物レベルの詳細な解析により、忌避学習の際にNMDARの下流でCaMKII-RhoA-ROCK/Rho-kinaseシグナル伝達経路が活性化されることが、シナプス可塑性[注5]の制御に重要であることを明らかにしました。この研究成果は、脳の可塑性メカニズムの理解を深めるだけでなく、精神・神経疾患の新たな治療法開発への道を開く可能性があります。
本研究成果は、米国科学誌「Science Signaling(サイエンス シグナリング)」(2024年9月10日付オンライン版)に掲載されました。
URL:https://www.science.org/doi/10.1126/scisignal.ado9852
研究成果のポイント
- 独自のリン酸化プロテオミクス解析技術「KIOSS法」[注6]を用いて、NMDARの下流でリン酸化されるタンパク質を大規模に同定しました
- NMDARの活性化がCaMKII-RhoA-ROCKシグナル伝達経路を誘導することを明らかにしました
- 側坐核[注7]のD2受容体発現-中型有棘神経細胞(D2R-MSN)において、CaMKII-RhoA-ROCKシグナル伝達経路が忌避学習に関与することを明らかにしました
- NMDARの機能不全が認められる精神・神経疾患の病態解明につながることが期待されます
背 景
私たちの脳では、数千億もの神経細胞が複雑なネットワークを形成し、絶え間なく情報をやり取りしながら、思考、感情、行動、学習・記憶を制御しています。この精巧な仕組みの中で、特に重要な役割を果たしているのがNMDA受容体(NMDAR)と呼ばれるタンパク質です。NMDARは神経細胞間の情報伝達を調整し、学習と記憶に不可欠な「シナプス可塑性」に関与します。シナプス可塑性とは、経験や活動に応じて神経細胞間のつながりの強さが変化する現象で、これにより新しい情報の獲得、保存、想起が可能になります。NMDARは、グルタミン酸[注8]という最も重要な神経伝達物質[注9]に反応して活性化され、細胞内にカルシウムイオンを流入させます。このカルシウムイオンの流入は、カルシウム依存性のタンパク質リン酸化酵素(キナーゼ)[注10]を活性化させ、「リン酸化」と呼ばれる化学反応を引き起こします。このリン酸化によってタンパク質の機能や活性が調節され、神経細胞の興奮性や可塑性、遺伝子発現が制御されることで、学習・記憶に寄与すると考えられています。このようなNMDARの働きは、脳の適応能力を支える重要なメカニズムであり、その機能異常は統合失調症やうつ病、依存症、てんかん、認知機能障害などの様々な精神・神経疾患と関連していることが知られています。しかし、NMDARの下流で具体的にどのようなタンパク質がリン酸化されるのかはほとんど解明されておらず、学習・記憶のメカニズムや精神・神経疾患との関連についても多くの謎が残っています。そのため、NMDARの下流で起こるリン酸化シグナルの全容を明らかにすることは、これらの疾患の病態解明や治療法開発への道を開く可能性があります。
これまでに、本研究グループは、細胞内のタンパク質リン酸化を高感度かつ網羅的に検出する独自のリン酸化プロテオミクス技術「KIOSS (Kinase-oriented substrate screening)法」を開発してきました。本研究ではKIOSS法を用いて、NMDAR活性化後に誘導されるリン酸化反応を大規模に解析し、神経細胞の可塑性および学習・記憶との関連を明らかにすることを目的としました。
研究成果
本研究グループは、KIOSS法を用いて、マウス脳の線条体および側坐核領域におけるNMDAR下流のリン酸化反応を網羅的に解析し、100種類以上のタンパク質とそのリン酸化部位を同定しました。得られたリン酸化タンパク質の情報を基に、パスウェイ解析[注11]を行い、NMDAR関連経路として低分子量Gタンパク質[注12]RhoA関連経路を特定しました。さらに、NMDARの下流で、カルシウム依存性キナーゼCaMKIIがRhoAの活性化制御因子(ARHGEF2やARHGAP21)をリン酸化することを明らかにし、ARHGEF2のリン酸化がRhoAの活性化を促進し、Rho関連キナーゼ(ROCK/Rho-kinase)を活性化することも示しました。加えて、マウスに不快な刺激(忌避刺激)を与えた際に側坐核のD2R-MSNにおいてCaMKII-RhoA-ROCKシグナル経路が活性化することを見出し、D2R-MSN特異的にROCKを抑制または欠損させると、シナプスの密度低下、長期増強[注13]の不安定化、忌避学習能力の低下が観察されました。また、ROCKによってリン酸化されるタンパク質を網羅的に同定し、ポストシナプスタンパク質SHANK3のリン酸化依存的にシナプス形態と忌避学習能が制御されることも明らかにしました。これらの結果から、忌避刺激に応じて側坐核のD2R-MSNのNMDARが活性化され、その下流でCaMKII-RhoA-ROCKシグナル伝達経路が働くことが、シナプスの可塑性と忌避学習の形成に重要な役割を果たすことが示されました。今後の展開
NMDARの機能異常は統合失調症やうつ病、認知機能障害などの精神・神経疾患と密接に関連しており、これらの疾患ではシナプス形成の異常が見られます。今回解明されたNMDAR下流のリン酸化シグナルは、これらの疾患の病態をより正確に理解し、新たな治療法を開発する手がかりとなる可能性があります。研究チームは今後、統合失調症やうつ病などの疾患モデル動物を用いて、特定されたリン酸化シグナル経路の異常をさらに詳しく調査する予定です。この研究により、各疾患の発症メカニズムとの関連性がより明確になり、シグナル分子を標的とした新しい治療法の開発につながる可能性があります。また、研究チームは得られたリン酸化タンパク質のデータを独自に開発したリン酸化データベース「KANPHOS(kinase-associated neural phospho-signaling), https://kanphos.jp」に登録し、世界中の研究者が利用できるようにしました。このデータベースの活用により、精神・神経疾患研究のさらなる進展が期待されます。
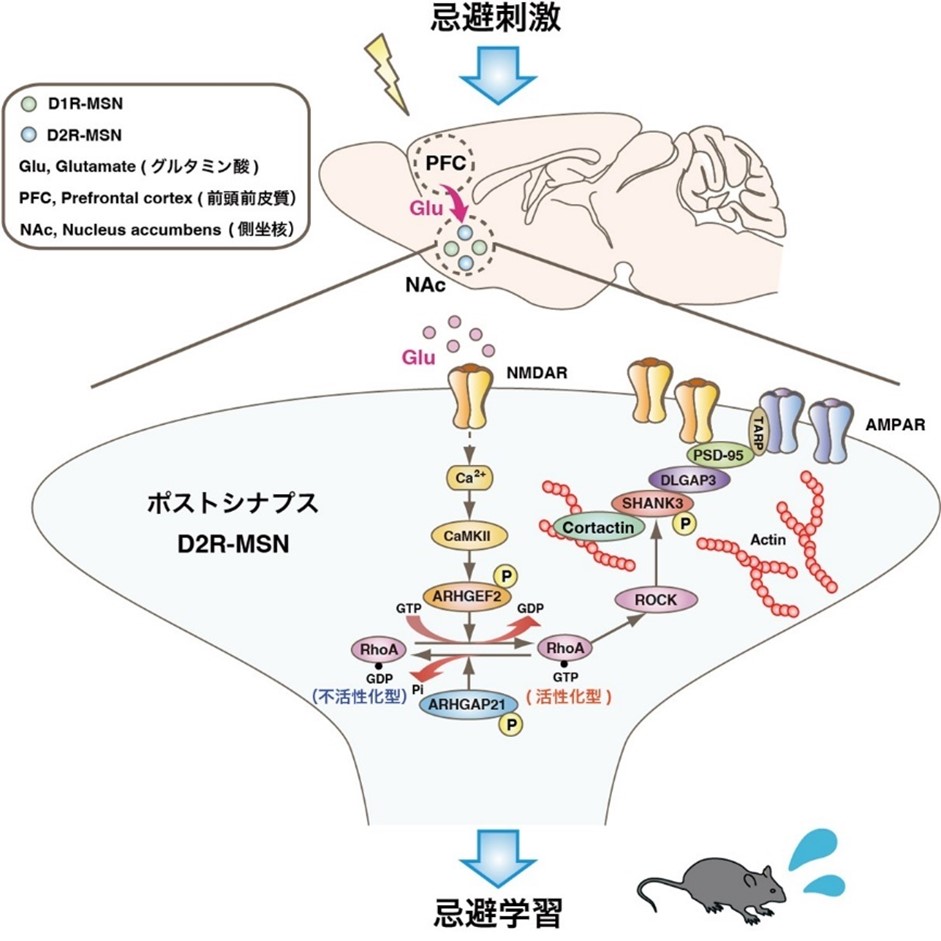
解説図説
図:忌避学習を制御するシナプス可塑性のメカニズム(Funahashi et al., Science Signaling 17(853):eado9852 (2024)を一部改変)
マウスが不快な刺激(忌避刺激)を受けると、前頭前皮質などからのグルタミン酸作動性入力により、側坐核のD2R-MSNに存在するNMDARが活性化され、カルシウムイオンが細胞内に流入します。このカルシウム流入は、カルシウム依存性キナーゼCaMKIIを活性化させます。活性化したCaMKIIは、RhoAの活性化制御因子であるARHGEF2やARHGAP21をリン酸化することで、RhoAを活性化します。その結果、ROCKが活性化されます。ROCKの活性化は、SHANK3などのポストシナプスタンパク質のリン酸化を引き起こし、これによりSHANK3、DLGAP3、PSD95、NMDARから構成されるタンパク質複合体の形成が促進されます。この複合体の形成は、受容体の細胞膜への安定的な局在化を促進し、同時にアクチン細胞骨格の再構築を誘導します。これらの分子メカニズムを通じて、シナプス可塑性が制御され、忌避学習が成立することが明らかになりました。
用語解説
注1 リン酸化プロテオミクス解析:
細胞内のタンパク質のリン酸化状態を網羅的に解析する手法のこと。タンパク質機能や細胞内シグナル伝達の調節に重要なリン酸化修飾を、質量分析計などを用いて大規模に同定します。注2 忌避学習:
生物が不快な刺激や経験を避けるために行動を変化させることで、不快な刺激と特定の状況や行動を関連付け、将来的にその刺激を回避するよう学習します。これにより、有害な状況から身を守る適応的な行動が形成されます。注3 NMDA受容体 (NMDA receptor, NMDAR):
脳の神経細胞間で情報伝達を行うグルタミン酸[注8]の受容体の一種。学習や記憶形成に重要な役割を果たし、シナプス可塑性[注5]に関与しています。注4 リン酸化:
タンパク質にリン酸基が付加される化学反応です。この反応は、タンパク質の構造や機能を変化させる重要な翻訳後修飾の一つです。リン酸化によって、タンパク質は活性化または不活性化されたり、他のタンパク質との相互作用が変化したりします。神経細胞では、リン酸化反応がシナプス可塑性や遺伝子発現の調節など、多くの重要なプロセスに関与しています。注5 シナプス可塑性:
神経細胞同士の接続部(シナプス)が、経験や学習によって変化する能力のことです。シナプス可塑性は、脳が新しい情報を学習し、記憶を形成する上で極めて重要なメカニズムです。この性質により、脳は環境の変化に適応し、新しい技能を獲得することができます。注6 KIOSS (Kinase-oriented substrate screening)法:
生体内でリン酸化されたタンパク質を特定するために開発されたリン酸化プロテオミクスの手法の一つです。この方法では、リン酸化されたセリン残基やスレオニン残基に結合するタンパク質や機能ドメインをコーティングしたアフィニティービーズを使用します。これにより、ハウスキーピングタンパク質や細胞骨格タンパク質を除去し、リン酸化されたタンパク質のみを優先的に濃縮することができます。濃縮されたリン酸化タンパク質はペプチドに切断され、その後、質量分析計を用いてタンパク質とそのリン酸化修飾を大規模に同定します。注7 側坐核:
報酬処理、快感、嗜好形成、恐怖反応、および意思決定プロセスを調節する重要な脳領域で、その神経細胞の大半は抑制性の中型有棘神経細胞(medium spiny neuron:MSN)です。これらのMSNは、発現するドーパミン受容体のサブタイプに基づいて、D1受容体発現型(D1R-MSN)とD2受容体発現型(D2R-MSN)に分類されます。D1R-MSNは報酬行動・学習に関与し、D2R-MSNは忌避行動・学習に関与すると考えられています。側坐核は、腹側被蓋野からドーパミン入力を、前頭前皮質、扁桃体、海馬などからグルタミン酸入力を受け取ります。これらの入力が側坐核内の神経活動を調節し、情動反応や意思決定プロセスを制御します。側坐核の抑制性出力は、脳幹や他の辺縁系領域の活動を調節することで、適応的な行動発現を制御しています。注8 グルタミン酸:
脳内で最も豊富に存在する興奮性の神経伝達物質[注9]です。グルタミン酸は、一つの神経細胞から別の神経細胞へ信号を伝達する際に重要な役割を果たします。特に、学習や記憶、認知機能に深く関与しています。注9 神経伝達物質:
神経から神経、神経から筋肉等の組織へ信号を伝達する低分子の化学物質。アセチルコリン、アドレナリン、ドーパミン、セロトニンなどのアミン類、グルタミン酸、グリシン、GABAなどのアミノ酸類、エンドルフィンのようなペプチド類など、多種多様な物質が神経伝達物質として働いていることが知られています。注10 タンパク質リン酸化酵素(キナーゼ):
タンパク質にリン酸基を付加する酵素の総称です。この過程をリン酸化と呼びます。キナーゼは細胞内シグナル伝達において中心的な役割を果たし、タンパク質の機能、局在、他のタンパク質との相互作用などを調節します。注11 パスウェイ解析:
オミックス実験(プロテオミクスなど)で得られたデータ(リン酸化タンパク質のリスト)を基に、既存の生物学的パスウェイデータベースと照合することで、関連するシグナル伝達経路や代謝経路を同定・予測する手法です。注12 低分子量Gタンパク質:
分子量約20-30kDaのGTP結合タンパク質で、細胞内シグナル伝達において重要な役割を果たします。代表的なものにRhoファミリー(RhoA、Rac、Cdc42など)があり、これらは細胞骨格の形成や機能を制御し、細胞形態の主な制御因子として働きます。GDPとGTPの結合状態を切り替えることで、スイッチのように機能し、様々な細胞機能を調節します。注13 長期増強:
シナプスの伝達効率が長時間にわたって増強される現象のこと。繰り返しの刺激によって引き起こされ、学習や記憶の形成に重要な役割を果たすと考えられています。この過程では、シナプスの構造や機能が変化し、神経細胞間の信号伝達が強化されます。研究資金
本研究は、日本医療研究開発機構(AMED)脳とこころの研究推進プログラム (JP19dm0207075, JP21wm0425017) ゲノム研究を創薬等出口につなげる研究開発プログラム(JP24tm0524001)、科研費 (JP17H01380, JP18K14849, JP21K06428, JP24K02138)、創発的研究支援事業(JPMJFR204H)、上原記念生命科学財団、武田科学振興財団、堀科学芸術振興財団、新潟大学脳研究所共同利用・共同研究の助成を受けたものです。文献情報
雑誌名:Science Signaling(2024年9月10日掲載)論文タイトル:Signal flow in the NMDA receptor–dependent phosphoproteome regulates postsynaptic plasticity for aversive learning
著者:
船橋 靖広1,2, Rijwan Uddin Ahammad1,2,10, 張 心健3, Emran Hossen1,2, 河谷 昌泰4, 中牟田 信一5, 吉見 陽6,7, 呉 敏華6, 王 緩緩1,2, 呉 夢雅1,2, 李 旭1,2, Md. Omar Faruk1,2, Md Hasanuzzaman Shohag5, 林 祐新1,2, 坪井 大輔1,2, 西岡 朋生1,2, 黒田 啓介5, 天野 睦紀5, 野田 幸裕6,7, 山田 清文6, 崎村 建司8, 永井 拓3, 山下 貴之4,11, 内野 茂夫9, 貝淵 弘三1,2
所属:
1. 藤田医科大学 医科学研究センター
2. 藤田医科大学 精神・神経病態解明センター 細胞生物学部門
3. 藤田医科大学 精神・神経病態解明センター 神経行動薬理学研究部門
4. 藤田医科大学 医学部 生理学
5. 名古屋大学大学院医学系研究科 神経情報薬理学
6. 名古屋大学大学院医学系研究科 医療薬学
7. 名城大学 薬学部 病態解析学
8. 新潟大学 脳研究所 モデル動物開発分野
9. 帝京大学 理工学部 バイオサイエンス学科
10. 南カリフォルニア大学 アルツハイマー治療研究所
11. 藤田医科大学 精神・神経病態解明センター 神経生理学部門
DOI: doi/10.1126/scisignal.ado9852
