医学部情報生命科学の国田勝行准教授らの研究成果が国際自然科学誌「Scientific Reports」に掲載されました
数理モデルの誤差を細胞内のセンサー分子を使って補正する、
コンピューターと細胞が協力するハイブリッドな
コンピューターと細胞が協力するハイブリッドな
バイオプロセス制御システムを開発
~医薬品、食品、化学材料などの有用物質生産への応用に期待~ 藤田医科大学(愛知県豊明市)医学部情報生命科学の国田勝行准教授(兼:精神・神経病態解明センター計算科学部門)、セントルイス・ワシントン大学エネルギー環境化学工学科のFuzhong Zhang教授、奈良先端科学技術大学院大学(奈良県生駒市)先端科学技術研究科バイオサイエンス領域の大久保智樹大学院生、データ駆動型サイエンス創造センターの作村諭一教授(兼:先端科学技術研究科バイオサイエンス領域)らの研究グループは、コンピューターと微生物が互いに協力する新しいバイオプロセスの制御システムを考案し、その有効性をシミュレーションで実証しました。
バイオプロセスとは、細菌や酵母などの生きた細胞を利用して、医薬品、食品、化学材料などの有用な物質を生産する技術です。これらの目的生産物の収量を左右する鍵となるのは、目的生産物の生合成を触媒するさまざまな酵素です。微生物が「合図」となる物質(誘導剤※1)に応答してこれらの酵素を多く作り出すように遺伝子を改変することで、目的生産物の生合成が速く進むようになります。一方で、酵素を過剰に作らせることは、微生物の増殖や生命維持にとっては負担になります。したがって、バイオプロセス全体の生産物収量を増やすためには、誘導剤を与える量とタイミングを調整して、酵素の発現をちょうどいいレベルに制御する必要があります。このような誘導剤の入力を最適化※2するために、細胞内のタンパク質や代謝物などの濃度変化を予測する数理モデル※3が利用されています。しかし、モデルの予測に大きな誤差があると、それを用いて計算された誘導剤の量やタイミングに「狂い」が生じ、結果として生産物の収量が減ってしまうという問題があります。本研究で提案した制御システムは、大腸菌に組み込まれた細胞内の代謝物を感知するセンサー分子により、モデル誤差による酵素レベルのずれを自律的に補正します。これはコンピューターが数理モデルを用いてバイオプロセスの全体を計画し、大腸菌がモデル誤差を補正する相互補完的なシステムです。このアプローチは、バイオプロセスにおけるモデル誤差の問題を克服する一助になると期待されます。
本研究成果は、国際自然科学誌「Scientific Reports(サイエンティフィック・リポーツ)」の2024年11月18日午前10時(BST)オンライン版に公開されました。
URL:https://www.nature.com/articles/s41598-024-76029-1
URL:https://www.nature.com/articles/s41598-024-76029-1
研究成果のポイント
- バイオプロセス制御におけるモデル誤差の問題を解決するために、モデルにもとづく入力最適化と人工遺伝子回路※4によるフィードバック制御※5を組み合わせたハイブリッドな制御システムを設計しました。
- ケーススタディとして、酵素によって細胞内に蓄積された中間代謝物を感知して自律的に酵素発現を抑制する人工大腸菌株に着目しました。
- モデル誤差を意図的に加えたシミュレーションにおいて、設計したハイブリッド制御システムが、モデル誤差による生産物収量の減少を緩和できることが実証されました。
背景
細菌や酵母などの生きた微生物を利用して、医薬品、食品、化学材料などの有用な物質を生産する工程をバイオプロセスとよびます。バイオプロセスで効率よく目的生産物を作り出すための基本的な方法は、目的生産物に至る反応経路を触媒する酵素の発現増強です。誘導剤などの入力に応答して酵素を発現する遺伝子回路を微生物に組み込むことで、目的生産物の合成速度を速めることが可能です。しかし、酵素の発現増強は、細胞内に蓄えられた栄養分などの資源を過剰に消費することで、細胞の増殖や生存を妨げるおそれがあります。そのため、バイオプロセス全体の収量を最大化するには、酵素の触媒作用と細胞への負担のバランスをとり、酵素発現を適切なレベルに制御する必要があります。そのためのアプローチのひとつは微生物の数理モデルを使った方法です。入力に対する微生物のふるまい(細胞の増殖、酵素の発現、代謝物の生産、栄養分の消費など)を数理モデルを使って予測することで、最適な入力を事前に決めることができます。この方法の問題点は、モデルの誤差により、事前に決めた入力のもとで酵素の発現レベルが最適ではなくなり、その結果、生産物の収量が減少してしまうことです。もうひとつのアプローチは、細胞内の代謝物を感知するセンサー分子を組み込むことで、微生物に自律的に酵素発現を制御させる方法です。実際の細胞の状態に合わせて臨機応変に酵素発現を調節できる点が特長ですが、コンピューターのように未来を予測して生産物収量を最大化するような微妙な制御は難しいという欠点があります。つまり、これらふたつのアプローチは互いの弱点を補い合う関係にあります。そこで、本研究ではこれらを組み合わせたハイブリッドな制御システムを設計し、モデル誤差がある場合でも生産物収量の減少が抑えられることをシミュレーションで示しました。
研究手法・研究成果
提案した制御システムの実証のために、本研究では以前にZhang教授らが開発した脂肪酸※6を生産する大腸菌株に着目しました。脂肪酸を生合成する際に細胞内で生じる重要な化学反応のひとつが、材料となるアセチルCoAから中間反応体であるマロニルCoAを作る反応です。この反応はアセチルCoAカルボキシラーゼ(ACC)という酵素によって触媒されます。ACCの発現増強は脂肪酸の生産量を増加させる一方で、細胞増殖や維持を阻害することが知られています。Zhang教授らの大腸菌には、マロニルCoAセンサーと制御スイッチのふたつの部分からなる遺伝子回路が組み込まれています(図1)。制御スイッチは、誘導剤に応答してACCの発現を開始します。ACCの増加にともない細胞内に蓄積したマロニルCoAが一定量に達すると、マロニルCoAセンサーがそれを検知し、制御スイッチに伝えます。すると代謝スイッチはACCの発現を緩めます。これにより遺伝子回路はACCの発現増強を適切なレベルに抑え、細胞増殖と生命活動への影響を軽減することができます。
研究グループはまず、さまざまな誘導剤濃度下での大腸菌の増殖と脂肪酸の生産を予測する数理モデルを構築しました。そしてそれを使って誘導剤の濃度を最適化するハイブリッドな制御システムを設計しました。これにより、ACCの増加による反応速度の改善と、細胞にかかる負担とのバランスを取り、脂肪酸生産量を最大化することが可能になります。次に、設計されたハイブリッド制御システムが、数理モデルの誤差に対して堅牢であることを示すために、シミュレーション上で脂肪酸の生産量を評価しました。シミュレーションでは、ACCが数理モデルによる予測よりも速く、あるいは遅く蓄積するような誤差をあえて加えました。誘導剤の濃度はACCの蓄積速度を考慮して最適化されているので、その予測が外れることは最終的な脂肪酸生産量にとって致命的です。それにも関わらず、シミュレーションの結果、細胞内のセンサー分子が実際のACCの増加を間接的に感知し、制御スイッチの切り替えタイミングをリアルタイムで調節することで、脂肪酸生産量の減少を抑えることができました。
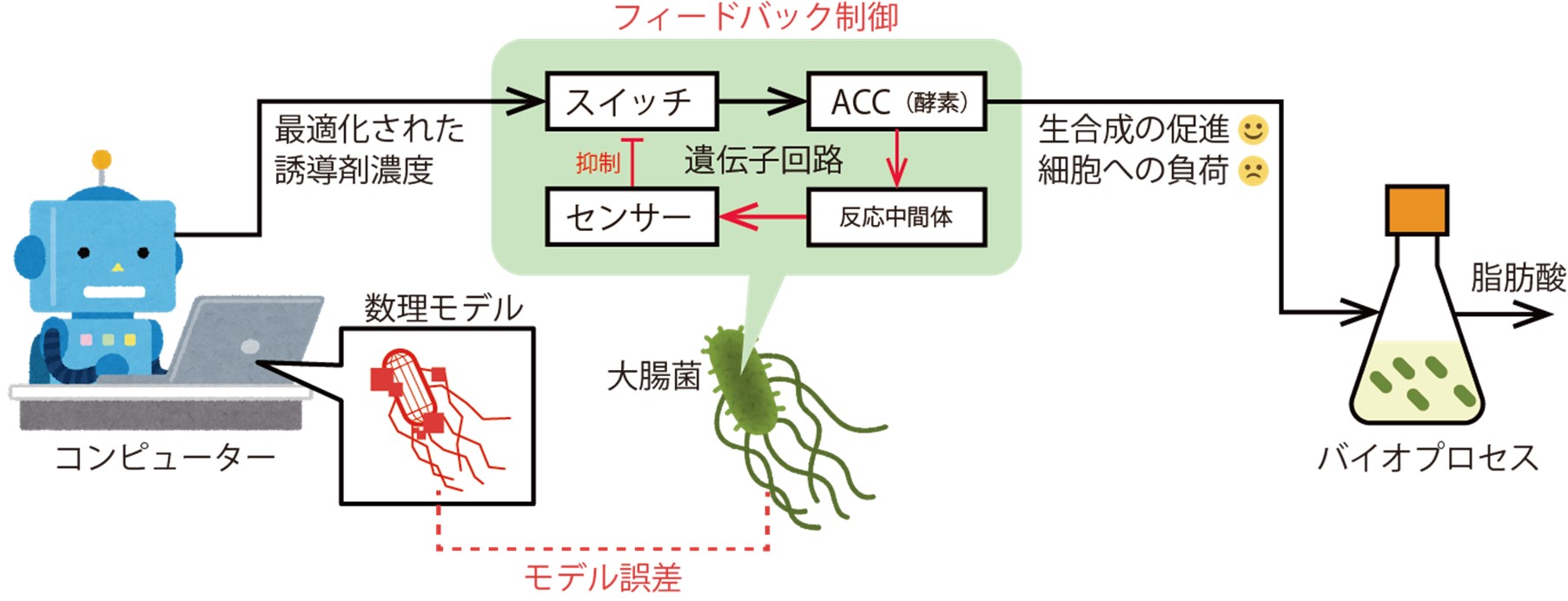
(図1)提案したハイブリッド制御システムの模式図。生産物(脂肪酸)の収量を最大化するために、コンピューターは数理モデルを使って最適な誘導剤入力を計画する。大腸菌は、モデル誤差による入力の狂いを、細胞内の代謝物センサー分子を使ったフィードバック制御により補正する。
今後の展開
本研究で実証されたハイブリッドな制御アプローチは、バイオプロセスにおけるさまざまな重要酵素の発現制御に応用可能です。細胞内の代謝物センサー分子を利用した本アプローチは、人工のセンサーや生化学分析を利用して継続的に細胞内のモニタリングをすることが難しい場合に極めて有効です。今後は、複数の酵素の発現を同時に制御したり、光遺伝学法※7を利用した可逆的な入力方法と組み合わせたりすることにより、数理モデルによる制御が持つ利点をより強く引き出すことが期待できます。
用語解説
※1 誘導剤
微生物の特定の遺伝子の発現を促す物質。
※2 (入力)最適化
入力によって結果が変わる何らかの現象に対して、数理モデルを使って、最も好ましい結果をもたらす入力を見つける手法。
※3 (細胞の)数理モデル
細胞の増殖や死滅、細胞内のタンパク質の発現や化学反応の速さを数式で表すことで、コンピューター上で細胞数や細胞内外の物質濃度の時間変化を再現(シミュレート)できるようにしたもの。
※4 人工遺伝子回路
さまざまな生物から得られた遺伝子を、ある機能を発揮するように組み合わせたもの。
※5 フィードバック制御
制御方式の一種で、出力を入力側に送り返して適切な値になるように出力を制御するもの。
※6 脂肪酸
炭素、水素、酸素で構成された分子で、脂質を構成する成分のひとつ。工業的に幅広く利用されており、塗料用樹脂原料や粉石鹸原料、樹脂原料、各種誘導体等の原料として使用されている。
※7 光遺伝学法
光によって活性化されるタンパク分子を細胞に発現させ、その機能を光で操作する技術。
文献情報
論文タイトル
A hybrid in silico/in‑cell controller that handles process‑model mismatches using intracellular biosensing
著 者
大久保智樹1, 作村諭一1,2, Fuzhong Zhang3, 国田勝行1,4
所 属
1. 奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス領域
2. 奈良先端科学技術大学院大学 データ駆動型サイエンス創造センター
3. Department of Energy, Environmental and Chemical Engineering, Washington University in St. Louis
4. 藤田医科大学 医学部 情報生命科学
