治験の流れ
ページ内目次
【 ばんたね病院 】
新規治験の流れ
| <施設調査> |
ばんたね病院の基本情報は、「施設情報・精度管理」のページに記載しています。 |
▼
| <新規治験の申請> |
| ①新規治験申込 治験の施設選定後、「新規治験実施依頼書」を治験・臨床研究支援センター管理者までメールにて提出してください。 (医師主導治験の場合) 新規治験実施依頼書を使用せず、治験・臨床研究支援センター管理者に直接ご相談ください。 |
| 申請依頼書類提出先 | (申請書類) 新規治験実施依頼書 | 【EXCEL】 |
| 件名:新規治験実施依頼書送付 宛先:治験・臨床研究支援センター管理者(chiken@fujita-hu.ac.jp) CC :ばんたね治験事務(chiken-bantane@fujita-hu.ac.jp) |
||
| ②IRB審査月の決定 依頼内容の確認後、IRB審査月を通知します。IRB審査月に合わせたヒアリング期間内でヒアリングの日程を調整します。 |
| ③Agathaの申請・登録 治験に係る文書の保管は、agathaによる電磁保管になります。「Agathaユーザー登録申請書」及び「Agathaユーザー登録申請書」をヒアリング前後に治験事務局(gcpjim@fujita-hu.ac.jp)まで提出してください。 |
▼
| <ヒアリング> |
| ①ヒアリング開催日の調整 担当CRCが、治験責任医師及び治験依頼者等と調整の上、通知したヒアリング実施期間内※で日程を決定します。 ※ページ下のヒアリングカレンダー参照 開催日:月~金 完全webでの実施も可 *治験事務局は、別の場所のため、対面で実施の場合も一部web/Mailを併用する場合があります。 |
| ②ヒアリング資料の提出 ヒアリング開催日の 10営業日 までに紙資料と電子資料を提出してください。 *期日までに資料が届かない場合には、ヒアリングを延期し、日程を再調整する場合があります。 ヒアリング資料の提出に関する詳細については、「治験書類に関する手順書」に記載しています。 --ヒアリング事前質問-- CRCや治験事務局がヒアリング資料を確認し、ヒアリング開催前に事前の質問リストを担当モニターにメールします。 ヒアリング前日までに回答をお願いします。 |
| ヒアリング資料提出先 | 提出に必要な資料は、「手順書・書式一覧」よりダウンロードしてください。 |
|
| 〚 電子資料 〛 | 件名:【治験薬記号】ヒアリング資料送付(●月IRB予定) 宛先:治験事務局(gcpjim@fujita-hu.ac.jp), 担当CRC |
|
| 〚 紙資料 〛 | 〒454-8509 愛知県名古屋市中川区尾頭橋三丁目6番10号 藤田医科大学ばんたね病院 治験・臨床研究支援センター(担当CRC) |
|
| ③ヒアリング <ヒアリングの内容>
<ヒアリング参加者>
|
| ④議事録の作成 ヒアリング終了後に、担当CRCと治験事務局で議事録を作成し、担当モニターに送ります。担当モニターは、内容を確認後、IRB開催日(祝日の場合は翌日)までに治験事務局に提出してください。 |
▼
| <IRB> |
| ①IRB申請資料提出 申請期間:IRB開催日の3週間前の金曜日(祝日の場合は前日) 17時まで(厳守) *郵送の場合は、上記提出日必着 IRB審議資料はAgathaにて提出してください。 Agathaを利用しない場合は、紙資料と電子資料の両方の提出をお願いします。 IRB資料の作成、提出の詳細につきましては、「手順書・書式一覧」のページ内の資料をご参照ください。 |
| 【IRB申請資料提出先】 |
〚電子資料〛 | 件名:【整理番号_治験薬記号】●月IRB送付 宛先:センター 治験事務局(gcpjim@fujita-hu.ac.jp), 担当CRC CC :ばんたね治験事務(chiken-bantane@fujita-hu.ac.jp) |
| 〚紙資料〛 | 〒470-1192 愛知県豊明市沓掛町田楽ヶ窪1番地98 藤田医科大学 治験・臨床研究支援センター 治験事務局 |
| ②IRB開催 毎月、第3週/4週(水) 17:00~ *月によっては変更になる場合あり *開催日の詳細は、「藤田医科大学病院群共同治験審査委員会」のページをご参照ください。 |
| <IRB説明用スライドについて> 治験責任医師が8分程度(10~15ページ以内)で説明できるスライドを作成し、治験責任医師(及びCRC)の確認の上、治験事務局に電子にて提出(Agathaを利用している場合は、Agathaの施設文書保管(13.IRBスライド資料)へ格納し、治験事務局へ「共有」をお願いします。 スライドには、以下 ①~⑩の内容を含めて作成してください。また、スライドにページ番号を記載してください。 ① 表紙 ② 治験薬について ③ 疾患の中での治験薬の位置づけ ④ 評価項目(主要評価項目・副次評価項目など) ⑤ 対象患者(選択基準・除外基準の概要など) ⑥ 治験のデザイン(割付群など) ⑦ スケジュール(検査Visit) *中間解析を実施する場合、スケジュール内に分かるように記載する ⑧ 有害事象・副作用、想定される安全性情報 ⑨ 治験薬の調製等に関して ⑩ 実施体制 (作成時の注意事項) ・略語を用いる場合、初めて記載する箇所に、定義又は説明を付けてください。 例)DN(糖尿病性腎症) ・有効性の評価で使用する特殊なスコア等を記載する際は、簡単な説明を追記ください。 |
▼
| <新規契約> |
| 契約に関する書類は、「手順書・書式一覧」よりダウンロードしてください。 一部の書類は、非公開となっています。担当CRCよりパスワードを確認してください。 *契約書類は、IRB申請段階で進めていただきますと、IRB承認後から契約締結までの時間を短縮できます。 |
▼
| <スタートアップミーティング> |
| 開催日:月~金 Webでの実施も可 契約締結後、治験開始に必要な条件が整った後に実施 <内容(例)> ①依頼者から治験の概要について説明 ②CRCより院内手順や注意事項を中心に説明 <参加者>
|
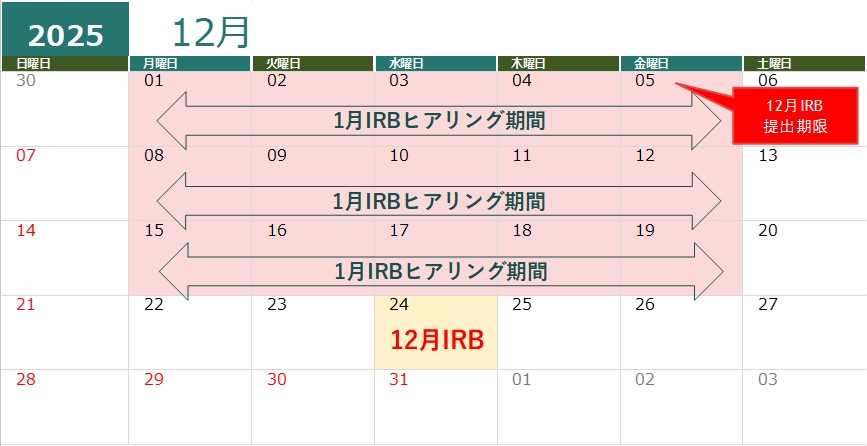
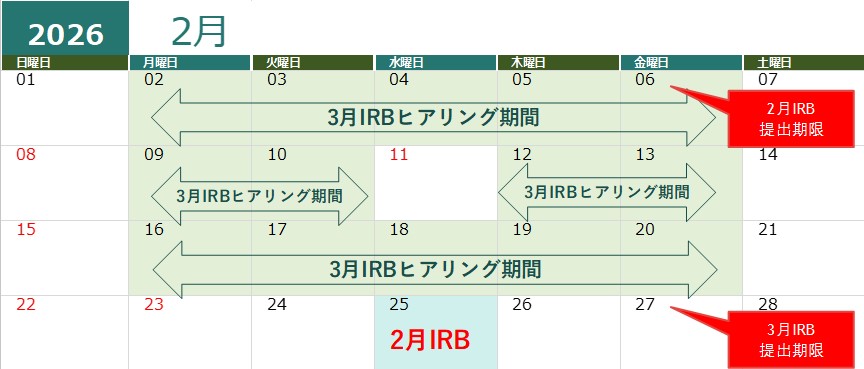
2024,2025年度ヒアリングカレンダー
ヒアリングはヒアリング期間に実施いたします。
ー
ー